Perfiles de Disolución y el Factor de Similitud > 50

El factor de similitud es la herramienta para registrar algunos medicamentos. Cuando un nuevo medicamento sale al mercado, detrás existen años de estudio, cantidad de ensayos tanto en animales como en humanos; en humanos sanos, en humanos con morbilidad, entre otros… Estos ensayos son para confirmar la eficacia del producto, la biodisponibilidad, la caracterización de ese activo, la farmacocinética, la farmacodinámica, estudios de formulación, de estabilidad, y todo lo necesario para que sea un producto de calidad, seguro y eficaz.
Cuando un segundo laboratorio quiere sacar al mercado ese mismo producto, necesita comprobar que va a tener las mismas características del producto innovador, que al administrárselo al paciente va a tener el mismo efecto, es decir, que va a ser bioequivalente con ese producto de referencia.
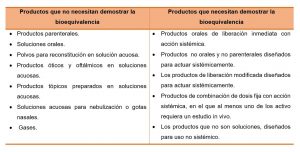
Tabla Nº1: Requerimiento de bioequivalencia
Para los productos que necesitan demostrar la bioequivalencia, ¿Cuál es la metodología existente?
Existen métodos in vivo y métodos in vitro.
Un método in vivo significa que tiene lugar dentro de un organismo vivo y los métodos in vitro quiere decir que se realiza fuera de un organismo vivo, el primero se demuestra a través de ensayos en humanos y el segundo se demuestra mediante el empleo de materiales y equipos de laboratorio. Otra diferencia importante son los costos tanto monetarios como de tiempo, acarreando mayor inversión en los estudios in vivo.
Dado las ventajas que presenta el estudio in vitro, lo ideal es demostrar la bioequivalencia del producto en estudio a través de métodos in vitro y con ellos solicitar en el momento de realizar el registro ante la autoridad sanitaria, una bioexención.
Y ¿Cómo se realizan los estudios in vitro?
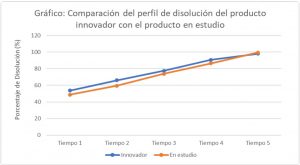
Para los productos sólidos los estudios in vitro se traducen en realizar perfiles de disolución tanto al producto en estudio como al producto innovador en condiciones fisiológicas, para luego comparar los resultados obtenidos, a través de un método estadístico conocido como factor de similitud.
El factor de similitud en la actualidad constituye el punto de referencia internacional en que se sustentan las agencias reguladoras para asegurar la similitud entre dos perfiles de disolución in vitro, cuando se compara el medicamento en estudio con el innovador, asegurando la intercambiabilidad. Cabe destacar, que no existe comparación de perfiles de disolución sin cálculo de factor de similitud.
Entonces, como todos a todos los productos sólidos se les realiza prueba de disolución, ¿todos se pueden registrar mediante una bioexención?
La respuesta es no. Existe una serie de argumentos y condiciones que se deben cumplir para solicitar la bioexención basadas en el Sistema de Clasificación Biofarmacéutica.
El enfoque según el Sistema de Clasificación Biofarmacéutica ofrece la posibilidad de eximir a algunos productos farmacéuticos sólidos de la necesidad de comprobar la bioequivalencia in vivo.
En conclusión, el objetivo de los perfiles de disolución y el factor de similitud es demostrar in vitro que el producto que estamos estudiando/desarrollando/registrando es bioequivalente al producto innovador.
Es importante estar siempre en sintonía con los últimos avances, porque al final los que desarrollamos, los que registramos, los que fabricamos, los que analizamos y aprobamos somos todos responsables de un medicamento.
Referencia:
- World Health Organization. WHO technical report series, No. 992 annex 7. Multisource (Generic) pharmaceutical products: guidelines on registration requirements to establish interchangeability. 2015